Publié dans le n° 158 des Dossiers de l'allaitement, mai 2020.
D'après : Human milk as "chrononutrition" : implications for child health and development. Hahn-Holbrook J et al., Pediatr Res 2019 ; 85(7) : 936-42.
La petite enfance représente une période importante pour l’installation des rythmes circadiens qui contrôlent notre physiologie et notre métabolisme. Le lait humain est l’aliment spécifiquement conçu pour l’alimentation du petit de notre espèce, et l’on peut supposer qu’il est également conçu pour favoriser la mise en place des rythmes circadiens humains, et qu’il constitue une forme de chrononutrition destinée à communiquer à l’enfant des informations qui varient en fonction de l’heure (Aparicio ; Engler). Par exemple, le lait humain contient un taux plus élevé de cortisol et de certains acides aminés en rapport avec l’éveil pendant la journée (Pundir ; Sánchez), tandis que celui de mélatonine et de tryptophane est plus élevé la nuit pour favoriser le sommeil et la restauration cellulaire (Engler ; Illnerova).
Lorsque le bébé est nourri directement au sein, il reçoit un lait correspondant au rythme circadien maternel. Mais de plus en plus de nourrissons reçoivent une quantité croissante de lait maternel exprimé qui pourra avoir été exprimé à une heure très différente de celle à laquelle il est donné au bébé, ce qui pourrait avoir un impact négatif sur le développement de ses rythmes circadiens. Il est donc surprenant que ce sujet reste aussi peu exploré. Si de nombreuses organisations recommandent de respecter la séquence colostrum, lait de transition et lait mature lorsqu’un enfant est nourri de lait maternel exprimé, il n’existe aucune recommandation sur l’intérêt de donner à l’enfant du lait maternel exprimé à l’heure approximative à laquelle il a va être donné, mis à part un article plaidant pour le respect du rythme circadien pour le don de lait maternel exprimé aux prématurés admis en néonatalogie (White). De plus, il n’existe aucune étude évaluant la possibilité d’un impact négatif du don de lait humain sans tenir compte des horaires d’expression et de don sur les rythmes circadiens de l’enfant. Aucune étude n’a recherché l’impact de l’allaitement versus l’alimentation avec une préparation pour nourrissons sur le rythme circadien de sécrétion du cortisol chez le nourrisson, les études sur l’évolution de ce taux portant sur des enfants exclusivement allaités (Ivars ; Thomas), ou ne fournissant pas de données sur l’alimentation de l’enfant (Custodio ; de Weerth). Et a fortiori, les études sur les enfants allaités ne prenaient pas en compte le fait que l’enfant le soit au sein ou reçoive plus ou moins régulièrement du lait maternel exprimé (Price).
Variations circadiennes de la composition du lait maternel
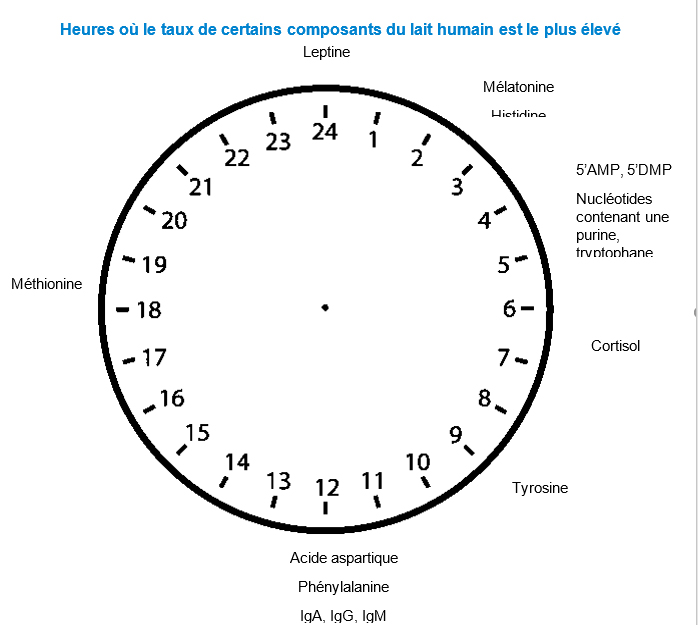
Le taux lacté des acides aminés, des minéraux et des micronutriments varie en fonction de l’heure. Par exemple, une étude a suivi l’évolution sur 24 heures du taux lacté des nucléotides (qui constituent les précurseurs des "briques" de l’ADN et de l’ARN, ainsi que de facteurs qui contrôlent la biosynthèse cellulaire) chez 30 femmes (Sánchez). Le taux de 5’AMP et de 5’GMP, des ribonucléotides comportant une base purique jouant un rôle important entre autres dans la sécrétion de mélatonine et de GABA, est plus élevé la nuit. Et le lait humain sécrété le jour contient un taux plus élevé d’acides aminés impliqués dans la sécrétion de neurotransmetteurs en rapport avec l’éveil : tyrosine (précurseur de l’adrénaline et de la noradrénaline), méthionine (un acide aminé souffré précurseur de l’acétylcholine), phénylalanine, acide aspartique et glycine (Sánchez). Si on a constaté des variations du taux lacté de méthionine et de tryptophane en fonction de l’heure dans le lait de transition, le taux de la plupart des acides aminés varie en fonction de l’heure dans le lait mature. Par ailleurs, le lait mature exprimé la nuit a un taux plus élevé de lipides que le lait exprimé pendant la journée, tant chez les mères d’enfants à terme (Daly ; Jackson ; Lammi-Keefe ; Moran-Lev) que chez les mères de prématurés (Lubetzky). Le taux lacté de fer est le plus élevé à midi tandis que celui de vitamine E est le plus élevé le soir (Barkova). Les taux de magnésium, de zinc et de potassium atteignent un pic pendant la matinée (Kara) tandis que celui du sodium survient en tout début de matinée (Keenan).
Le taux des facteurs endocrines du lait humain varie fortement en fonction de l’heure de la journée, les deux hormones pour lesquelles ces variations sont les plus importantes étant le cortisol et la mélatonine. Ces deux hormones ont fait l’objet d’un certain nombre d’études en raison de leur importance pour la régulation du métabolisme (Bass) et de l’activité immunitaire (Scheiermann). Par exemple, le suivi du taux lacté de cortisol avant et après chaque tétée sur 24 heures chez 23 mères a constaté que ce taux était 3,3 fois plus élevé entre 4 et 10 heures qu’entre 16 et 22 heures (2,97 ng/ml contre 0,69 ng/ml – Pundir). Le cortisol lacté provient du sang maternel, et les variations de son taux lacté sont parallèles aux variations sériques et salivaires chez la mère. De même, les taux sériques et lactés maternels de mélatonine sont intercorrélés, avec une augmentation en fin de journée et un pic pendant les premières heures du jour, les variations circadiennes du taux lacté étant visibles dès les premiers jours post-partum (Engler ; Illnerova ; Sánchez, 2013). Des variations circadiennes du taux lacté d’autres hormones ont également été constatées même si elles sont moins nettes. Par exemple, le taux lacté de leptine, une hormone qui régule les apports caloriques en induisant un sentiment de satiété, suit une rythmicité bimodale (Cannon). Une étude a constaté que son taux lacté était significativement plus élevé entre 22 heures et 4 heures qu’entre 4 et 22 heures, ce qui correspond aux variations du taux plasmatique maternel (Langendonk). Des études sur des animaux ont constaté un pic de la sécrétion lactée de leptine chez des rats environ 10 jours après la naissance (vers le milieu de leur période d’allaitement), qui pourrait participer à la programmation métabolique du petit (Nozhenko ; Pinsky). Le lait humain contient également de la prolactine (Gala), qui pourrait favoriser l’absorption des nutriments au niveau intestinal (Yuen). Des études ont recherché les variations circadiennes du taux d’adiponectine (Martin), d’insuline (Whitmore), de ghréline (Aydin ; Kierson) et d’hormones thyroïdiennes (Rodriguez-Palmero), mais les données les concernant restent succinctes.
Il existe encore peu de données sur les variations circadiennes des facteurs immunitaires, mais ce domaine commence à être mieux exploré. Il semble que certains facteurs importants soient présents à un taux plus élevé pendant la journée, en particulier en post-partum précoce (Franca). Le colostrum diurne avait un taux plus élevé d’IgA, de C3 et de C4 (des protéines du système du complément) et de polynucléaires que le colostrum nocturne. Une étude a fait état d’un taux plus élevé d’interféron gamma pendant la journée que pendant la nuit dans le lait mature, l’inverse ayant été constaté dans le lait de transition (Silva). Une autre étude consatait des variations circadiennes du taux de diverses cytokines (Morais) ; en particulier, le taux d’IL-6 était plus élevé le jour que la nuit dans le colostrum. Les données actuelles montrent que le taux de certains composants nutritionnels, hormonaux et immunitaires du lait humain varient suivant un rythme circadien. D’autres études sont nécessaires pour mieux comprendre ces variations et pour évaluer leur impact fonctionnel éventuel chez l’enfant allaité.
Rythme circadien et santé infantile
Toutes nos fonctions biologiques suivent un rythme circadien : éveil/sommeil, rythme respiratoire, température corporelle, digestion, métabolisme, sécrétion des diverses hormones… (Scheiermann). On a constaté chez les adultes qu’une dysrégulation des rythmes circadiens induisait divers problèmes de santé : troubles immunitaires (Sephton ; Schrepf), troubles du sommeil (Riemann ; Saridjan ; Van Lenten), problèmes psychologiques (Bhattacharyya ; Kel-ler). Mais nous savons très peu de choses sur l’impact du rythme circadien chez les jeunes enfants. On sait que les nourrissons qui souffrent de coliques ont un rythme anormal de sécrétion du cortisol (taux plus bas le matin et plus élevé le soir) par rapport aux nourrissons qui n’en souffrent pas (White). Et les nourrissons hospitalisés en néonatalogie et exposés en continu à la lumière ont un moins bon comportement alimentaire, une moins bonne croissance et séjournent plus longtemps en néonatalogie que les nourrissons qui bénéficient d’une alternance lumière/obscurité (Brandon ; Mann ; Miller ; Vásquez-Ruiz).
Tant chez les enfants que chez les adultes, l’horloge biologique suit un cycle régulier de 24 heures, déterminé par divers stimuli environnementaux (lumière, repas…). Chez les mammifères, le contrôle de cette horloge se situe dans le noyau suprachiasmatique cérébral, et il est essentiellement régulé par l’alternance jour/nuit détectée par la rétine (Scheiermann). Cette horloge "centrale" régule les rythmes de tout notre organisme en synchronisant les horloges "périphériques" qui gèrent le fonctionnement de toutes nos cellules (Challet). Le noyau suprachiasmatique déclenche la sécrétion d’une cascade d’hormones par le système hypothalamo-hypophyso-surrénalien (axe HHS), qui réguleront la sécrétion de cortisol, de catécholamines, de mélatonine, de leptine… La mélatonine a un impact sédatif et favorise l’adaptation aux variations saisonnières de luminosité (Cajochen ; Pévet). La sécrétion de leptine est plus élevée la nuit pour bloquer la sensation de faim. Les taux de ces diverses hormones peuvent également interagir entre eux.
Émergence du rythme circadien chez le nourrisson
L’horloge biologique n’est pas totalement fonctionnelle chez le nourrisson. Si certains rythmes apparaissent très rapidement chez le nouveau-né à terme (variations circadiennes de la température par exemple), d’autres se développeront progressivement pendant les premiers mois de vie, comme le rythme veille/sommeil, repos/activité et le rythme circadien de sécrétion des hormones (Rivkees). Ce développement sera favorisé par l’exposition de l’enfant à un rythme lumière/obscurité (Guyer ; Vásquez-Ruiz), aux interactions entre l’enfant et les personnes qui s’en occupent (Thomas) et aux autres stimuli environnementaux tels que le bruit ambiant (Wachman). Il existe d’importantes différences entre les études sur le moment où un rythme circadien de sécrétion du cortisol est détectable, les délais allant de 2 semaines à 9 mois suivant les études (Custodio ; de Weerth ; Ivars ; Kiess ; Lewis ; Price ; Santiago ; Spangler). L’établissement d’un rythme circadien correct de sécrétion du cortisol semble capital pour la régulation du taux de glucose, d’insuline et d’hormone de croissance (Hastings), et semble jouer un rôle dans l’acquisition d’un rythme régulier d’alimentation et de sommeil (Schlarb ; Spangler). Dans une étude sur 130 enfants chez qui le taux sérique de cortisol a été suivi tous les mois pendant la première année (Ivars), un rythme circadien de sa sécrétion était détectable dès 4 semaines chez certains enfants, mais il existait de très importantes variations individuelles, certains enfants présentant déjà un certain rythme circadien quelques jours après la naissance tandis que ce n’était toujours pas le cas chez d’autres enfants à 6 mois. Ces différences pourraient être partiellement en rapport avec l’exposition de l’enfant aux variations circadiennes de certains composants du lait maternel, et des études comparant des enfants allaités directement au sein versus des enfants nourris avec une préparation pour nourrissons sont nécessaires pour le vérifier.
Mécanismes potentiels de régulation du rythme circadien infantile via le lait maternel
Les variations du taux lacté de cortisol pourraient être un mécanisme important de régulation de l’horloge biologique de l’enfant via le lait maternel. On a constaté chez des animaux que le cortisol présent dans le lait maternel passait dans le sang et le cerveau du petit (Angelucci). Chez les humains, on a constaté que le taux lacté de cortisol avait un impact sur le développement de l’enfant : un taux lacté plus élevé de cortisol à 3 mois post-partum était corrélé à une taille plus élevée et à un indice de masse corporelle plus bas à 2 ans (Hahn-Holbrook). Les enfants des mères ayant un taux lacté plus élevé de cortisol sont plus craintifs (Grey). L’impact du taux lacté maternel de cortisol sur le développement neurologique du petit a ég-lement été constaté chez des singes et des rongeurs (Catalani, 2 études ; Casolini). Le niveau d’exposition du petit au cortisol présent dans le lait maternel semble également affecter le nombre de récepteurs aux glucocorticoïdes au niveau de l’hippocampe, avec un impact co-gnitif et comportemental pouvant durer toute la vie. Et on a constaté que l’administration exogène de glucocorticoïdes pouvait modifier le rythme circadien (Balsalobre). Il est donc tout à fait plausible que les variations du taux lacté maternel de cortisol modulent l’horloge biologique du bébé.
La mélatonine est également absorbée au niveau du tractus digestif chez des rongeurs, et elle passe ensuite dans de nombreux tissus (Reppert). On a constaté un taux urinaire nocturne plus élevé de 6-sulfatoxymélatonine (un métabolite de la mélatonine) chez les enfants allaités que chez les enfants nourris au lait industriel (Cubero), ce qui peut expliquer que les enfants allaités ont un sommeil plus efficient et moins fragmenté en début de vie que les enfants nourris au lait industriel (Cubero ; Engler). Dans une étude comparant des enfants de 2 à 6 mois randomisés pour recevoir soit la même préparation 24 heures sur 24, soit la même préparation pour nourrissons mais enrichie en tryptophane pour les tétées nocturnes, ces derniers avaient un sommeil de meilleure qualité et une synthèse plus élevée de mélatonine (Aparicio ; Kennaway). Pendant l’essentiel de l’histoire de l’humanité, le petit de notre espèce a pu compter sur le lait maternel pour recevoir la mélatonine dont il avait besoin, et il n’est donc pas étonnant que les systèmes neuroendocrine et métabolique immatures chez lui ne synthétisent pas efficacement avant environ le troisième mois post-partum les protéines nécessaires pour transformer le L-tryptophane reçu dans son alimentation en sérotonine, puis en mélatonine (Kennaway).
Conséquences possibles de l’absence de respect des rythmes circadiens lors du don de lait maternel exprimé
Autrefois, lorsque l’allaitement directement au sein était la norme universelle, les nourrissons recevaient un lait maternel qui n’était pas aligné sur le rythme jour/nuit maternel uniquement si l’horloge biologique de la mère était perturbée de façon majeure. Si le lait maternel joue un rôle dans la mise en place des rythmes circadiens chez l’enfant, le fait de donner régulièrement à un enfant du lait maternel exprimé à une heure différente de celle à laquelle il le reçoit peut envoyer un message discordant, similaire à celui reçu dans des situations perturbant gravement l’horloge biologique maternelle (Doom ; Evans ; Glynn, 2 études). Dans des études sur des nourrissons humains ou des petits de mammifères exposés au stress pendant la grossesse ou en début de vie (alternance imprévisible et irrégulière de lumière et d’obscurité, bruits intenses survenant irrégulièrement, chocs électriques…), ceux-ci souffraient de retard du développement (Baram ; Bremmer ; Davis ; Freide ; Sarro ; Tyler), d’hypervigilance (Clarke ; Sarro), de maturité sexuelle précoce (Simpson) et d’une durée de vie plus courte (Brumbach). Certes, on ne sait actuellement pas dans quelle mesure le devenir et la santé des enfants seront affectés par le taux de certains facteurs présents dans le lait maternel, mais il est très probable que la consommation d’un lait maternel dont le taux de cortisol s’élève de façon imprévisible et aléatoire peut donner à l’organisme de l’enfant des raisons de penser qu’il vit dans un environnement instable et dangereux.
Le lait humain collecté par les lactariums est habituellement regroupé en pools sans aucune prise en compte des horaires auxquels les divers lots de lait mélangés ensemble ont été exprimés. On peut supposer que ce lait contient un taux relativement stable de cortisol, le mélange supprimant les variations circadiennes normales de ce taux. On ignore quel est l’impact de la consommation de lait humain contenant un taux stable de cortisol chez les nourrissons, mais on a constaté que l’administration de faibles doses de glucocorticoïdes en continu pendant toute la journée à des souris adultes avait un impact négatif sur le rythme circadien au niveau musculaire et hépatique (Koyanagi). On a également constaté que l’administration matinale de mélatonine chez des adultes induisait une sédation (Cajochen). On peut donc supposer que l’administration matinale à un nourrisson de lait maternel exprimé pendant la nuit et contenant un taux élevé de mélatonine induira chez lui une sédation. On ignore quel impact à long terme cela peut avoir sur le développement de l’enfant, et des études sur le sujet sont nécessaires.
Implications et recherches nécessaires
Plusieurs questions nécessitent notre attention. Tout d’abord, il est indispensable de mieux connaître et comprendre les variations circadiennes de la composition du lait maternel et leurs éventuelles modifications pendant la lactation. L’impact épigénétique de ces variations circadiennes sur le développement de l’enfant et la programmation métabolique et immunitaire doit également être étudié. Un impact épigénétique est en effet hautement probable (Verduci). Une étude in vitro a constaté que le lait humain supprimait l’activation du promoteur du gène codant pour l’IL-8 via l’inhibition du facteur nucléaire kappa-B (Minekawa). L’impact épigénétique du lait humain peut également se faire via sa modulation du microbiote infantile. Il serait donc nécessaire de voir dans quelle mesure le volume de lait maternel consommé, sa composition et les horaires auxquels il est consommé peuvent avoir un impact épigénétique (Asher).
Des études randomisées devraient être menées afin d’analyser l’impact de l’absorption de lait maternel consommé à l’heure correspondante sur la santé infantile à court et à long terme, dans la mesure où une dysrégulation de l’horloge biologique peut avoir un impact négatif sur à peu près tous nos mécanismes physiologiques, cet impact étant particulièrement préoccupant chez le nourrisson chez qui les rythmes circadiens sont en cours d’installation, comme les études sur les prématurés l’ont constaté. Il serait déjà possible d’informer les mères qui tirent régulièrement leur lait de noter l’heure d’expression sur le récipient de stockage, et de sélectionner par la suite le lait dont l’horaire d’expression est le plus proche possible de l’horaire du repas de l’enfant.
Mieux connaître les variations circadiennes de la composition du lait maternel pourrait révéler des opportunités d’interventions pour optimiser la santé infantile, en sélectionnant du lait maternel exprimé pendant des plages horaires spécifiques afin de mieux répondre à des besoins spécifiques du nourrisson (taux plus élevé d’IgA et de cellules immunocompétentes chez des bébés souffrant de pathologies infectieuses par exemple). Les lactariums pourraient choisir de constituer les pools de lait en sélectionnant des échantillons prélevés dans des tranches horaires données, afin de pouvoir fournir du lait humain exprimé le matin, l’après-midi ou la nuit. Nous commençons tout juste à explorer le domaine important de la chrononutrition chez les nourrissons, et il nous reste beaucoup à apprendre sur le rôle du lait maternel en la matière.
Références bibliographiques à voir dans le n° 158 des DA.







EXCELLENT PAPIER
Pour poser une question, n'utilisez pas l'espace "Commentaires" ci-dessous, envoyez un mail à la boîte contact. Merci