Publié dans le n° 167 des Dossiers de l'allaitement, février 2021.
D'après : Presentation and management of food allergy in breastfed infants and risks of maternal elimination diets. Rajani PS et al. J Allergy Clin Immunol Pract 2020 ; 8 : 52-67.
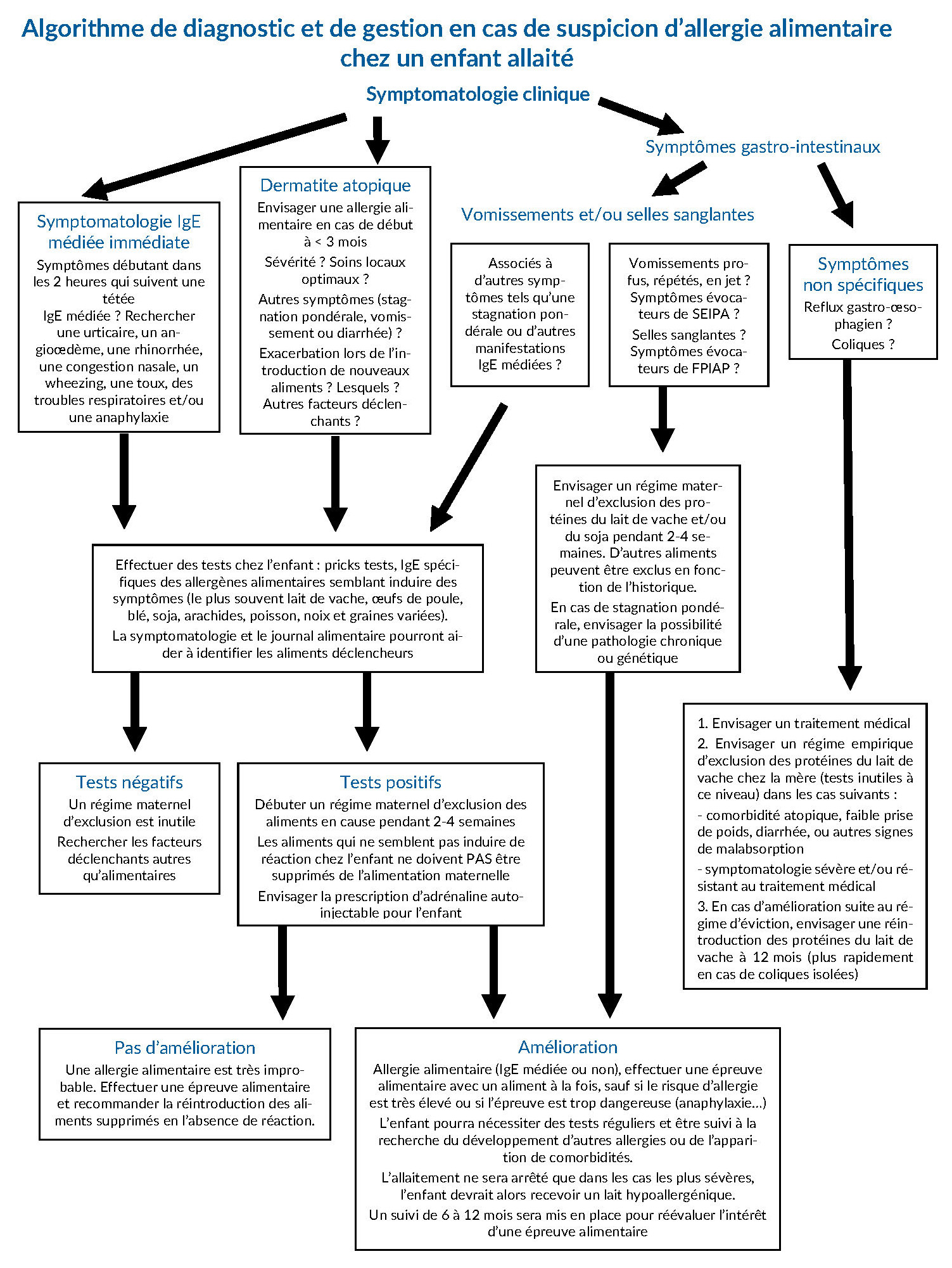
Les données concernant l’impact de l’allaitement sur le risque d’allergie sont difficilement interprétables. La gestion des enfants allaités qui présentent des signes cliniques d’allergie alimentaire peut être difficile, tant en raison de la variété des symptômes possibles que de celle des stratégies optimales à mettre en œuvre. Il est important de commencer par déterminer si les manifestations sont réellement liées à une allergie alimentaire, si elles sont suffisamment importantes pour nécessiter la recherche de la cause et la mise en place d’un régime maternel d’éviction lorsque l’enfant est exclusivement allaité, et dans quelle mesure ces stratégies ne vont pas, à plus long terme, empêcher l’acquisition d’une tolérance orale et augmenter le risque de sensibilisation à d’autres allergènes. Les auteurs font le point sur les données existantes, et proposent un algorithme pour le diagnostic et la gestion des allergies alimentaires chez les bébés allaités.
Présentation des allergies alimentaires chez les enfants allaités
Les réactions anaphylactiques chez les enfants exclusivement allaités sont rares, mais elles peuvent survenir et leur symptomatologie peut être peu spécifique et donc plus difficile à reconnaître (Greenhawt). Deux cas de réactions immédiates après consommation maternelle de poisson ont été décrits chez des enfants exclusivement allaités. Un épisode anaphylactique avec vomissements, urticaire, toux et wheezing a été décrit chez un bébé de 4 mois quelques minutes après avoir pris le sein alors que sa mère avait consommé du poisson quelques heures auparavant, et des IgE spécifiques de plusieurs poissons ont été retrouvées chez l’enfant (Monti). Chez l’autre enfant, âgé de 5 mois, un wheezing et une urticaire se sont déclarés dans l’heure qui a suivi une tétée alors que la mère avait consommé du poisson quelques heures plus tôt (Arima). Dans les deux cas, l’arrêt de la consommation maternelle de poisson a réglé le problème. Un bébé âgé de 8 jours auquel on avait commencé à donner une préparation pour nourrissons à base de caséine a développé une léthargie, d’importants vomissements, une hypotension, une cyanose et des selles sanglantes après avoir reçu 3 biberons (Lifschitz). La mère a repris l’allaitement exclusif en éliminant tous les produits contenant du lait de vache de son alimentation. Quelques semaines plus tard, l’enfant a reçu un biberon de lait maternel qui avait été exprimé et congelé avant le début du régime maternel d’exclusion, et l’enfant a présenté les mêmes symptômes. Un hydrolysat à base de caséine a été toléré pendant quelques jours avant la récidive des symptômes. Le bébé avait des IgE spécifiques de l’alpha-lactalbumine et de la bêta-lactoglobuline. À 12 mois, l’enfant tolérait la consommation directe de lait de vache.
Les dermatites atopiques sont un problème relativement courant chez les bébés des pays industrialisés (Roduit ; Worldwide variation in prevalence of symptoms of asthma…), et on estime leur prévalence entre 10 et 30 %, environ 16 % survenant pendant la 1ère année de vie. Environ 1/3 des enfants présentant une forme modérée à sévère ont des IgE spécifiques des allergènes alimentaires (Eigenmann, 2 études ; Schneider). La consommation des aliments en cause déclenche habituellement une poussée dans les 6 à 48 heures suivantes (Bergmann). Le rôle joué par les allergènes alimentaires présents dans le lait maternel, en particulier les protéines du lait de vache, est couramment évoqué par les parents, mais il reste souvent difficile de déterminer une conduite clinique (Sidbury). Dans une étude danoise, 2,2 % des enfants ont développé une allergie aux protéines du lait de vache (Host) ; parmi eux, 17 (44 %) l’ont développée alors qu’ils étaient allaités et 9 d’entre eux alors qu’ils étaient exclusivement allaités ; les symptômes ont disparu chez 8 enfants après éviction des protéines du lait de vache de l’alimentation maternelle et ont récidivé après consommation maternelle d’au moins 500 ml de lait de vache. Une étude a suivi 37 enfants allaités dont 32 l’étaient exclusivement et qui souffraient de dermatite atopique (Cant) ; cette étude présentait divers biais méthodologiques, mais elle démontrait toutefois qu’un enfant exclusivement allaité pouvait réagir à un allergène alimentaire absorbé via le lait maternel. Les auteurs d’une autre étude avaient suivi 27 enfants allaités dont 17 présentaient une allergie aux protéines du lait de vache ; 14 d’entre eux étaient exclusivement allaités (Järvinen). Les mères ont supprimé les protéines du lait de vache de leur alimentation pendant 2 à 4 semaines, puis ont consommé du lait de vache avant de mettre leur bébé au sein sous supervision médicale ; tous les enfants allergiques aux protéines du lait de vache ont présenté une poussée de dermatite sauf 1, tandis qu’aucun des 10 enfants ne souffrant pas d’allergie n’a présenté de réaction. Une étude japonaise a évalué l’impact du café, du chocolat et de divers aliments fermentés consommés par les mères chez 92 enfants exclusivement allaités souffrant de dermatite atopique, et concluait que les symptômes infantiles s’amélioraient chez 73 % des enfants après élimination de ces produits de l’alimentation maternelle (Uenishi). Une récidive a été constatée dans les 3 jours après reprise de la consommation de ces aliments par les mères pendant 3 jours de suite, les produits les plus souvent en cause étant le chocolat, les yaourts, la sauce de soja et la soupe miso. Globalement, il semble bien là encore que les enfants exclusivement allaités et souffrant de dermatite atopique peuvent réagir à certains aliments consommés par la mère, les symptômes disparaissant lorsqu’elle arrête de les consommer et réapparaissant si elle en consomme à nouveau. Toutefois, la prévalence de l’allergie aux protéines du lait de vache est basse chez les enfants souffrant de dermatite atopique.
Les proctocolites induites par des allergènes alimentaires (FPIAP) sont relativement courantes et jusqu’à 60 % des cas sont constatés chez des enfants exclusivement allaités (Nowak-Wegrzyn). Toutefois, une infection virale peut également provoquer l’émission de selles sanglantes. Plus de 20 % des enfants présentant une FPIAP présentent également une dermatite atopique, et 25 % ont des antécédents familiaux d’atopie (Nowak-Wegrzyn). Outre les protéines du lait de vache, le soja, les œufs, le blé et le maïs peuvent induire une FPIAP (Caubet ; Erdem ; Nowak-Wegrzyn), et plusieurs aliments peuvent être en cause (Arik Yilmaz ; Lake ; Odze). Une étude constatait que lorsque l’enfant souffrant de FPIAP était exclusivement allaité, les symptômes disparaissaient après éviction des protéines du lait de vache de l’alimentation maternelle (Erdem). Dans une autre étude, tous les enfants exclusivement allaités (41 %) réagissaient aux protéines du lait de vache et 14 % au blanc d’œuf (Arik Yilmaz). Une étude constatait que tous les enfants souffrant de FPIAP réagissaient aux protéines du lait de vache et que 17 % réagissaient également à un autre aliment (Kaya). Enfin, une étude constatait la disparition de la FPIAP chez 5 des 6 enfants exclusivement allaités après suppression des protéines du lait de vache de l’alimentation maternelle, tandis qu’une préparation à base d’acides aminés s’est avérée nécessaire chez le dernier enfant (Xanthakos), ce qui suggère que soit la mère n’avait pas supprimé toutes les protéines du lait de vache de son alimentation, soit l’enfant réagissait également à un autre allergène. Globalement, les protéines du lait de vache semblent être le principal allergène en cause dans la survenue des FPIAP chez les enfants exclusivement allaités.
Le syndrome d’entérocolite induite par les protéines alimentaires (SEIPA) combine habituellement des vomissements et des diarrhées chroniques avec ou sans présence de sang dans les selles, sans qu’il soit possible de déterminer une relation précise avec les repas. Dans certains cas, les symptômes sont suffisamment importants pour induire une stagnation staturo-pondérale, une léthargie, une déshydratation et des troubles métaboliques (Michelet ; Nowak-Wegrzyn). Le SEIPA peut être aigu, avec de fréquents vomissements, souvent en jets, avec léthargie, pâleur, déshydratation et hypotension dans les heures qui suivent l’exposition à l’allergène alimentaire si cette exposition est ponctuelle ou peu fréquente, tandis qu’il est chronique lorsque cette exposition est quotidienne (Michelet). Les aliments les plus souvent en cause sont les protéines du lait de vache et le soja, les aliments solides pouvant également avoir cet impact (Caubet ; Katz ; Sicherer). Le 1er cas de SEIPA chez un enfant exclusivement allaité était survenu chez un nourrisson de 1 mois et les manifestations cliniques ont disparu après éviction des protéines du lait de vache de l’alimentation maternelle (Monti). Un autre cas de SEIPA aigu a été rapporté chez un enfant exclusivement allaité après consommation maternelle d’une grande quantité de crème glacée au soja (Tan). Un autre rapport présentait 2 cas de SEIPA aigus liés à la consommation maternelle de lait de vache, qui ont été résolus par un régime maternel d’éviction (Kaya). Une étude a suivi 27 nourrissons souffrant de SEIPA dont 6 étaient exclusivement allaités, et un régime maternel d’exclusion a réglé le problème chez certains enfants (Arik Yilmaz). Une étude a décrit 2 cas de SEIPA liés à la consommation maternelle de lait de vache (Miceli Sopo). Les données sur le sujet permettent de penser que les protéines alimentaires excrétées dans le lait maternel peuvent induire un SEIPA aigu ou chronique chez l’enfant exclusivement allaité.
Aucun cas d’œsophagite à éosinophiles (EEo) n’a été rapporté chez les enfants allaités. Dans la mesure où ce problème est relativement rare (0,5 à 1/1 000 enfant – Dellon), on hésitera à effectuer une endoscopie pour la rechercher. 2 études ont évalué sa prévalence dans une population pédiatrique (Dalby ; Spergel), mais elles ne fournissaient pas de données sur l’alimentation des enfants. D’après l’expérience des auteurs de cet article, une EEo peut survenir chez un nourrisson allaité et disparaît souvent avec l’introduction d’une préparation pour nourrissons hypoallergénique.
Les allergènes alimentaires dans le lait maternel
Des études ont constaté la présence de divers allergènes alimentaires dans le lait humain, incluant l’ovalbumine (Metcalfe ; Palmer), la bêta-lactoglobuline (Järvinen ; Sorva), la gliadine (Chirdo) et l’arachide (Bernard ; Schocker, 2 études ; Vadas). Toutefois, leur taux lacté est habituellement infime, et on ignore si un taux aussi bas peut réellement avoir un impact clinique. Selon les études, environ la moitié à 2/3 des mères excrètent des protéines alimentaires dans leur lait, et ce à des taux très variables suivant les mères, sans que cela induise régulièrement des symptômes chez leur bébé (Metcalfe ; Schocker ; Sorva ; Vadas). Le délai entre l’ingestion par la mère et l’apparition de l’allergène dans son lait est très variable d’une mère à l’autre et suivant les allergènes : 1-2 heures pour les protéines du lait de vache, 1-8 heures pour l’arachide, jusqu’à 8 heures pour l’œuf. Ces allergènes persistent dans le lait maternel pendant des durées variables (1 à 12 heures), et le pic lacté est également très variable : jusqu’à 10 µg/l pour la bêta-lactoglobuline, 300 µg/l pour l’arachide, 50-300 µg/l pour l’Ara h2 et l’Ara h6, 4-8 µg/l pour l’ovalbumine (Bernard ; Kilshaw ; Metcalfe ; Palmer ; Schocker ; Sorva ; Vadas). Donc globalement, ces allergènes semblent excrétés uniquement chez certaines mères (tout au moins à un taux détectable), à des taux variables, avec des cinétiques lactées variables et un impact clinique chez l’enfant difficile à déterminer, les raisons de ces importantes variations individuelles étant inconnues. Certains estiment qu’elles pourraient être en rapport avec les méthodes de détection de ces allergènes. Une étude permettait de penser que les mères dont l’enfant allaité présentait une allergie aux protéines du lait de vache avaient un schéma spécifique d’excrétion lactée de la bêta-lactoglobuline par rapport à celles dont l’enfant ne présentait pas d’allergie (Sorva), et une autre que les allergènes de l’arachide pouvaient former des complexes immuns avec les IgA et les IgG (Ohsaki).
Il est possible d’effectuer des tests allergologiques de recherche des allergènes alimentaires en utilisant le lait maternel. On a constaté que les prick tests effectués avec du lait maternel collecté après consommation maternelle de lait de vache, d’œuf ou d’arachide induisaient une réaction positive chez l’enfant allaité sensibilisé (Martin-Munoz). Le rôle des allergènes alimentaires présents dans le lait maternel a été démontré par des épreuves de réintroduction alimentaire maternelle en milieu hospitalier, chez 27 enfants allaités âgés de 1,8 à 9,4 mois, dont la mère suivait depuis plusieurs semaines un régime strict d’éviction alimentaire, qui ne présentaient aucun signe clinique d’allergie au moment de cette réintroduction (Järvinen), et qui ont été régulièrement mis au sein après consommation maternelle du lait de vache. 11 enfants qui présentaient une allergie aux protéines du lait de vache ont réagi 2 à 9 heures après la réintroduction.
Enfin, des réactions allergiques à des allergènes humains semblent possibles. Bien que cela soit rare, il y a des cas où les manifestations d’allergie présentées par un bébé ne disparaissent qu’après arrêt total de l’allaitement, l’enfant recevant une préparation pour nourrissons hypoallergénique. Les causes peuvent être variées : respect insuffisant du régime d’exclusion maternel, allergie infantile non liée à un allergène alimentaire ou réaction de l’enfant à une protéine endogène du lait maternel. Les principales protéines allergisantes du lait de vache sont l’alpha-lactalbumine, l’alpha1-caséine et la kappa-caséine, et elles sont également présentes dans le lait humain, l’alpha-lactalbumine et la bêta-caséine étant les plus abondantes (Järvinen). Les séquences de l’alpha-lactalbumine bovine et humaine sont identiques à 78 %, tandis qu’elles sont identiques à respectivement 49 % et 52 % pour la bêta-caséine et la kappa-caséine (Järvinen). Des réactions croisées sont donc possibles si le bébé allaité est sensibilisé aux protéines du lait de vache. Une étude a trouvé des IgE qui réagissaient aux protéines du lait humain chez plus de 80 % des bébés allergiques aux protéines du lait de vache, certains d’entre eux ayant des prick tests positifs au lait maternel (Schulmeister), et ce type d’IgE était constaté chez jusqu’à 60 % des enfants allaités alors que leur mère suivait un régime d’éviction très strict (Järvinen). Deux études ont constaté une réaction croisée entre l’alpha-lactalbumine bovine et humaine (Schocker, 2 études). Il semble donc qu’une sensibilisation secondaire aux protéines humaines du lait maternel puisse parfois survenir.
Diagnostic et gestion d’une allergie alimentaire chez le bébé allaité
En cas de troubles nettement corrélés à une allergie IgE médiée (éruption cutanée, vomissements, toux, wheezing) peu de temps après une tétée, un planning de recherche d’une allergie sera mis en œuvre. Le meilleur outil pour détecter l’aliment en cause est un interrogatoire approfondi sur les symptômes (moment de survenue, sévérité), leur association avec la consommation de certains aliments par la mère et leur évolution lorsque la mère cesse de les consommer. La tenue d’un journal sur l’alimentation de la mère et les symptômes infantiles sera mise en œuvre. On envisagera ensuite des prick tests et/ou la recherche d’IgE spécifiques de divers aliments.
Comme noté plus haut, la dermatite atopique est en rapport avec une allergie alimentaire chez environ 1/3 des enfants (Eigenmann). Et ce pourcentage est d’autant plus élevé que la dermatite est survenue précocement et qu’elle est sévère (Forbes ; Hill). Les aliments les plus souvent en cause sont les protéines du lait de vache, les œufs et l’arachide. La dermatite est alors souvent associée à une stagnation pondérale, des vomissements ou des diarrhées (Rance), symptômes dont la présence doit faire rechercher une allergie alimentaire chez les enfants souffrant de dermatite. La première étape sera donc d’analyser les caractéristiques de la dermatite. À noter qu’une allergie alimentaire est habituellement à exclure si l’enfant présente des périodes sans dermatite en l’absence de toute modification alimentaire maternelle, de l’introduction d’un nouvel aliment chez l’enfant ou d’un traitement médical de la dermatite. Le fait que l’enfant présente une aggravation suite à l’introduction d’un nouvel aliment est en revanche évocateur d’allergie alimentaire (Arkwright). La tenue d’un journal alimentaire sera recommandée. Il est important d’exclure les autres causes de lésions cutanées (infection bactérienne ou virale, stress émotionnel, réaction locale à un produit irritant…). Il est important de veiller au respect du traitement cutané local avant d’effectuer des tests allergologiques, sauf en cas de dermatite majeure ou d’impact significatif sur la croissance de l’enfant (Burks). On a constaté que les traitements locaux étaient souvent peu respectés (Krejci-Manwaring) alors qu’ils aidaient les parents à moins se focaliser sur la possibilité d’allergies alimentaires (Thompson), ce qui est utile dans la mesure où seulement 35 à 50 % des enfants dont les parents sont convaincus qu’ils souffrent d’allergie alimentaire en souffrent réellement (Bergmann ; Sampson). Il sera donc nécessaire d’effectuer des prick tests (en commençant par les allergènes les plus courants si le journal alimentaire ne permet pas d’avoir une idée fiable des aliments en cause), de rechercher les IgE spécifiques et parfois de faire des épreuves de suppression/réintroduction. Lorsque l’aliment en cause est dépisté, on tentera un régime maternel d’éviction de cet aliment. Si ce régime est efficace, il est crucial de faire après un certain temps une épreuve de réintroduction, dans la mesure où l’allergie peut avoir spontanément disparu (Cant). Si l’enfant réagit à nouveau, le régime d’éviction sera repris. Dans le cas contraire, on évitera la poursuite d’un régime devenu inutile.
Dans un pourcentage relativement important, l’allergie alimentaire se manifestera par des troubles gastro-intestinaux non IgE-médiés (Heine). Outre les FPIAP, SEIPA et EEo, on peut également rencontrer divers problèmes non spécifiques tels que le reflux gastro-œsophagien, la constipation, les coliques ou les selles sanglantes (Sicherer). La présence de sang dans les selles doit également amener à envisager une constipation avec fissures anales, une pathologie inflammatoire intestinale, une invagination intestinale, une malformation vasculaire intestinale, une colite infectieuse, une carence en vitamine K, une maladie de Hirschsprung ou une tumeur cancéreuse. Un interrogatoire détaillé sur le contexte sera donc important. À noter que la présence de sang dans les selles peut être occulte et détectée uniquement à l’aide d’un test approprié (Gralton), mais qu’en pareil cas, une allergie alimentaire est rarement en cause. De plus, ce test présente de nombreux faux positifs et ne devrait être envisagé que dans le contexte de suspicion d’une pathologie inflammatoire intestinale chronique ou d’une stagnation pondérale pour laquelle aucune cause n’a été retrouvée (Boyle ; Ford-Jones ; Muller ; Sullivan). En cas de FPIAP, un régime strict d’éviction chez la mère allaitante sera nécessaire, en commençant par les protéines du lait de vache qui sont les plus souvent en cause. Il n’est pas nécessaire au départ d’effectuer des prick tests ou de rechercher les IgE spécifiques ; cela ne sera fait que si l’éviction des aliments les plus souvent impliqués s’avère peu ou pas efficace. Dans la majorité des cas, le régime d’éviction est efficace dans les 72 à 96 heures mais, chez certains enfants, cela pourra nécessiter jusqu’à un mois (Lake). À noter que chez 20 % des enfants, le problème finit par disparaître sans que la mère suive un régime d’éviction (Nowak-Wegrzyn). Et à 12 mois, plus de 50 % des enfants toléraient l’aliment déclenchant les manifestations allergiques (Kaya). L’Academy of Breastfeeding Medicine a publié un protocole sur la gestion des FPIAP chez les enfants exclusivement allaités.
Les vomissements peuvent être difficiles à différencier des renvois importants, et un historique détaillé sera nécessaire. L’existence de vomissements fréquents et répétés 1 à 4 heures après une tétée, associée à une léthargie et à une pâleur sera évocatrice d’un SEIPA. Des recommandations officielles ont été publiées sur le diagnostic et la gestion de ce problème (Nowak-Wegrzyn). Des prick tests et/ou la recherche d’IgE spécifiques seront envisagés en présence de comorbidités. Concernant l’EEo, des examens invasifs tels que l’endoscopie seront envisagés uniquement devant les formes sévères ne répondant pas au traitement, ou en cas d’autres manifestations cliniques telles qu’une dysphagie ou une stagnation pondérale. Souvent, le diagnostic sera envisagé suite à la constatation des réactions de l’enfant en cas de réintroduction d’une préparation pour nourrissons standard après une période d’alimentation avec une préparation hypoallergénique, ou lors de l’introduction d’un nouvel aliment chez le bébé.
Le reflux est un phénomène courant chez les nourrissons en raison de l’immaturité du sphincter qui ferme le bas de l’œsophage et du fait qu’ils passent beaucoup de temps en position horizontale. Une étude a constaté qu’à 5 mois, 50 à 72 % des enfants régurgitaient au moins 1 fois par jour (Hegar). En cas de reflux gastro-œsophagien (RGO) plus important que la moyenne, un régime maternel d’exclusion des protéines du lait de vache pourra l’améliorer chez 16 à 42 % des enfants suivant les études (Cavataio ; Iacono Staiano). Il semble qu’une allergie aux protéines du lait de vache est plus souvent en cause en cas de RGO important (Nielsen), et un régime maternel d’exclusion mérite alors d’être tenté. Souvent, cela induit une amélioration du RGO, et cela peut même s’avérer efficace sur d’autres symptômes tels que la dermatite, une prise de poids insuffisante, une malabsorption ou des diarrhées (Hill ; Sicherer ; Vandenplas). L’administration de médicaments anti-reflux sera parfois envisagée chez l’enfant. À 12 mois, la réintroduction des protéines du lait de vache sera tentée dans la mesure où de nombreux reflux auront disparu à cet âge, même si l’enfant présente une allergie alimentaire (Allen ; Hegar).
Des études ont fait état d’une corrélation entre des coliques importantes et une allergie aux protéines du lait de vache (Hill ; Jakobsson). Certains auteurs ont rapporté une amélioration suite à un régime maternel d’éviction (Hill ; Lucassen). Dans certains cas sévères, le don à l’enfant d’une préparation pour nourrissons à base de soja s’est avéré efficace (Iacono). D’autres études concluaient qu’un régime maternel d’éviction des allergènes pouvait être utile, en particulier en présence de comorbidités telles que des selles sanglantes, des vomissements ou une dermatite atopique (Dobson ; Hall ; Iacovou), mais les études sur le sujet présentent des biais et d’autres études seraient nécessaires sur le sujet. Dans la mesure où l’amélioration est bien souvent évaluée subjectivement, on pourra tenter une élimination des protéines du lait de vache de l’alimentation maternelle en cas de coliques importantes. À noter qu’un RGO important peut également induire des coliques sévères, et cela devrait être recherché. Il n’existe pas d’études ayant constaté qu’un régime maternel d’éviction était susceptible d’améliorer une constipation chez l’enfant allaité. Une étude a constaté qu’elle était liée à une allergie aux protéines du lait de vache chez seulement 1 % des enfants qui en souffraient (Loening-Baucke). On ne peut donc recommander un tel régime devant une constipation isolée chez un enfant exclusivement allaité.
Considérations nutritionnelles
Les enfants souffrant d’allergie alimentaire ne doivent pas être exposés à l’aliment (aux aliments) en cause, et cela inclut l’exposition via le lait maternel dans certains cas. L’allaitement est la norme pour le petit de notre espèce et il présente pour lui de nombreux bénéfices. Un régime maternel d’éviction des aliments impliqués afin de permettre la poursuite de l’allaitement est donc la première stratégie à mettre en œuvre en cas de manifestations d’allergie chez un bébé allaité. Cela ne signifie en aucun cas que l’alimentation de la mère allaitante doit être parfaite. Toutefois, la mère allaitante a besoin d’une alimentation équilibrée, et l’éviction de certains aliments ayant une valeur nutritionnelle significative pourra être difficile, en particulier lorsque plusieurs aliments couramment présents dans notre alimentation doivent être éliminés (produits laitiers, œufs, blé, poisson…). Cela pourra induire des carences chez la mère, et celle-ci devrait être suivie par un nutritionniste, et éventuellement prendre des compléments alimentaires (Allen ; Copp). Si le taux lacté de macronutriments dépend peu de l’alimentation maternelle, la nature des lipides lactés dépend des réserves maternelles et des apports alimentaires (Bzikowska-Jura). Un apport suffisant en acides gras polyinsaturés est recommandé pendant la grossesse et l’allaitement. Les apports lipidiques jouent aussi un rôle dans le statut pour les vitamines liposolubles (Daniels ; Hollis ; Zielinska). Le taux lacté de certains micronutriments est fonction des apports alimentaires maternels (choline, vitamine B6, vitamine B12…) et un taux lacté insuffisant pourra avoir un impact négatif chez l’enfant allaité (Fischer ; Roepke ; Dror). Un régime maternel d’éviction mal équilibré pourra également être dangereux pour la santé maternelle (Adams). Lorsque l’enfant n’est plus exclusivement allaité, l’éviction de certains aliments pourra induire également des carences chez lui, et retentir sur sa croissance (Beck ; Flammarion ; Mehta ; Meyer, 2 études ; Robbins). Un suivi régulier de la dyade par un nutritionniste sera donc recommandé.
Conclusions et implications
Le fait qu’un bébé exclusivement allaité puisse réagir à un aliment consommé par sa mère via une exposition aux protéines alimentaires présentes dans le lait maternel est largement démontré, et ce phénomène pourrait être plus fréquent qu’on le pense. Toutefois, la majorité des études sur le sujet portent sur peu d’enfants et il est difficile d’évaluer avec fiabilité la prévalence de ce problème. Une évaluation soigneuse sera essentielle : interrogatoire détaillé, évaluation clinique, tenue d’un journal alimentaire, tests allergologiques…, en particulier si les symptômes sont importants. L’objectif devrait toutefois être d’éviter un régime d’exclusion inutile, et le suivi devrait prendre avant tout en compte la stabilité clinique et la croissance de l’enfant.
Les données sur l’excrétion lactée de protéines alimentaires sont limitées, ainsi que son impact potentiel chez l’enfant allaité. Des études sur le sujet sont nécessaires afin de mieux comprendre quel niveau d’exposition déclenche l’apparition de manifestations d’allergie chez l’enfant, les raisons pour lesquelles certains enfants réagissent alors qu’ils sont exposés uniquement aux protéines alimentaires présentes dans le lait maternel alors que d’autres ne réagissent que lorsque les aliments en cause sont introduits dans leur alimentation. Il n’existe pas de test de détection des allergènes alimentaires dans le lait humain. Développer des méthodes multiples de détection de ces allergènes serait très utile pour évaluer leur excrétion lactée, faciliter le diagnostic des aliments en cause (en particulier en cas d’allergie à plusieurs aliments) et améliorer le suivi des dyades. Cela pourrait également permettre de connaître les limites dans lesquelles un allergène alimentaire présent dans le lait maternel est susceptible d’induire un problème chez l’enfant allaité.
Références
- Academy of Breastfeeding Medicine. ABM Clinical Protocol #24 : allergic proctocolitis in the exclusively breastfed infant. Breastfeed Med 2011 ; 6 : 435-40. https://www.lllfrance.org/vous-informer/fonds-documentaire/textes-de-l-academy-of-breastfeeding-medicine/1641-proctocolite-allergique-chez-le-bebe-exclusivement-allaite
- Adams J et al. The safety of maternal elimination diets in breastfeeding mothers with food-allergic infants. Breastfeed Med 2014 ; 9 : 555-6.
- Allen KJ et al. Management of cow’s milk protein allergy in infants and young children : an expert panel perspective. J Paediatr Child Health 2009 ; 45 : 481-6.
- Allen LH. B vitamins in breast milk : relative importance of maternal status and intake, and effects on infant status and function. Adv Nutr 2012 ; 3 : 362-9.
- Arik Yilmaz E et al. Characteristics of children with food protein-induced enterocolitis and allergic proctocolitis. Allergy Asthma Proc 2017 ; 38 : 54-62.
- Arima T et al. Immediate systemic allergic reaction in an infant to fish allergen ingested through breast milk. Asia Pac Allergy 2016 ; 6 : 257-9.
- Arkwright PD et al. Management of difficult-to-treat atopic dermatitis. J Allergy Clin Immunol Pract 2013 ; 1 : 142-51.
- Beck C et al. Persistent food allergy and food allergy coexistent with eczema is associated with reduced growth in the fi rst 4 years of life. J Allergy Clin Immunol Pract 2016 ; 4 : 248-256.e3.
- Bergmann MM et al. Evaluation of food allergy in patients with atopic dermatitis. J Allergy Clin Immunol Pract 2013 ; 1 : 22-8.
- Bernard H et al. Peanut allergens are rapidly transferred in human breast milk and can prevent sensitization in mice. Allergy 2014 ; 69 : 888-97.
- Boyle JT. Gastrointestinal bleeding in infants and children. Pediatr Rev 2008 ; 29 : 39-52.
- Burks AW et al. ICON : food allergy. J Allergy Clin Immunol 2012 ; 129 : 906-20.
- Bzikowska-Jura A et al. The concentration of omega-3 fatty acids in human milk is related to their habitual but not current intake. Nutrients 2019 ; 11 : E1585.
- Cant AJ et al. Effect of maternal dietary exclusion on breast fed infants with eczema : two controlled studies. Br Med J 1986 ; 293 : 231-3.
- Caubet JC et al. Clinical features and resolution of food protein-induced enterocolitis syndrome : 10-year experience. J Allergy Clin Immunol 2014 ; 134 : 382-9.
- Caubet JC et al. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol 2017 ; 28 : 6-17.
- Cavataio F et al. Clinical and pH-metric characteristics of gastro-oesophageal reflux secondary to cows’ milk protein allergy. Arch Dis Child 1996 ; 75 : 51-6.
- Chirdo FG et al. Presence of high levels of non-degraded gliadin in breast milk from healthy mothers. Scand J Gastroenterol 1998 ; 33 : 1186-92.
- Copp K et al. Nutrition support team guide to maternal diet for the human-milk-fed infant. Nutr Clin Pract 2018 ; 33 : 687-93.
- Dalby K et al. Eosinophilic oesophagitis in infants and children in the region of southern Denmark : a prospective study of prevalence and clinical presentation. J Pediatr Gastroenterol Nutr 2010 ; 51 : 280-2.
- Daniels L et al. Micronutrient intakes of lactating mothers and their association with breast milk concentrations and micronutrient adequacy of exclusively breastfed Indonesian infants. Am J Clin Nutr 2019 ; 110 : 391-400.
- Dellon ES, Hirano I. Epidemiology and natural history of eosinophilic esophagitis. Gastroenterology 2018 ; 154 : 319-332.e3.
- Dobson D et al. Manipulative therapies for infantile colic. Cochrane Database Syst Rev 2012 ; 12 : CD004796.
- Dror DK, Allen LH. Effect of vitamin B12 deficiency on neurodevelopment in infants : current knowledge and possible mechanisms. Nutr Rev 2008 ; 66 : 250-5.
- Eigenmann PA et al. Prevalence of IgE-mediated food allergy among children with atopic dermatitis. Pediatrics 1998 ; 101 : E8.
- Eigenmann PA, Calza AM. Diagnosis of IgE-mediated food allergy among Swiss children with atopic dermatitis. Pediatr Allergy Immunol 2000 ; 11 : 95-100.
- Erdem SB et al. Tolerance development in food protein-induced allergic proctocolitis : single centre experience. Allergol Immunopathol 2017 ; 45 : 212-9.
- Fischer LM et al. Choline intake and genetic polymorphisms in fl uence choline metabolite concentrations in human breast milk and plasma. Am J Clin Nutr 2010 ; 92 : 336-46.
- Flammarion S et al. Diet and nutritional status of children with food allergies. Pediatr Allergy Immunol 2011 ; 22 : 161-5.
- Forbes LR et al. Food allergies and atopic dermatitis : differentiating myth from reality. Pediatr Ann 2009 ; 38 : 84-90.
- Ford-Jones AE, Cogswell JJ. Tests for occult in stools of children. Arch Dis Child 1975 ; 50 : 238-40.
- Gralton KS. The incidence of guiac positive stools in newborns and infants. Pediatr Nurs 1999 ; 25 : 306-8.
- Greenhawt M et al. Guiding principles for the recognition, diagnosis, and management of infants with anaphylaxis : an expert panel consensus. J Allergy Clin Immunol Pract 2019 ; 7 : 1148-1156.e5.
- Hall B et al. Infantile colic : a systematic review of medical and conventional therapies. J Paediatr Child Health 2012 ; 48 : 128-37.
- Hegar B et al. Natural evolution of regurgitation in healthy infants. Acta Paediatr 2009 ; 98 : 1189-93.
- Heine RG. Pathophysiology, diagnosis and treatment of food protein-induced gastrointestinal diseases. Curr Opin Allergy Clin Immunol 2004 ; 4 : 221-9.
- Hill DJ et al. Confirmation of the association between high levels of immunoglobulin E food sensitization and eczema in infancy : an international study. Clin Exp Allergy 2008 ; 38 : 161-8.
- Hill DJ et al. Effect of a low-allergen maternal diet on colic among breastfed infants : a randomized, controlled trial. Pediatrics 2005 ; 116 : e709-15.
- Hill DJ et al. Role of food protein intolerance in infants with persistent distress attributed to reflux esophagitis. J Pediatr 2000 ; 136 : 641-7.
- Hill DJ, Hosking CS. Infantile colic and food hypersensitivity. J Pediatr Gastroenterol Nutr 2000 ; 30 : S67-76.
- Hollis BW et al. Maternal versus infant vitamin D supplementation during lactation : a randomized controlled trial. Pediatrics 2015 ; 136 : 625-34.
- Host A et al. A prospective study of cow’s milk allergy in exclusively breastfed infants : incidence, pathogenetic role of early inadvertent exposure to cow’s milk formula, and characterization of bovine milk protein in human milk. Acta Paediatr Scand 1988 ; 77 : 663-70.
- Iacono G et al. Gastroesophageal reflux and cow’s milk allergy in infants : a prospective study. J Allergy Clin Immunol 1996 ; 97 : 822-7.
- Iacono G et al. Severe infantile colic and food intolerance : a long-term prospective study. J Pediatr Gastroenterol Nutr 1991 ; 12 : 332-5.
- Iacovou M et al. Dietary management of infantile colic : a systematic review. Matern Child Health J 2012 ; 16 : 1319-31.
- Jakobsson I, Lindberg T. Cow’s milk proteins cause infantile colic in breastfed infants : a double-blind crossover study. Pediatrics 1983 ; 71 : 268-71.
- Järvinen KM et al. Cow’s milk challenge through human milk evokes immune responses in infants with cow’s milk allergy. J Pediatr 1999 ; 135 : 506-12.
- Järvinen KM et al. Presence of functional, autoreactive human milk-speci fi c IgE in infants with cow’s milk allergy. Clin Exp Allergy 2012 ; 42 : 238-47.
- Järvinen KM, Chatchatee P. Mammalian milk allergy : clinical suspicion, cross-reactivities and diagnosis. Curr Opin Allergy Clin Immunol 2009 ; 9 : 251-8.
- Katz Y et al. The prevalence and natural course of food protein-induced enterocolitis syndrome to cow’s milk : a large-scale, prospective population-based study. J Allergy Clin Immunol 2011 ; 127 : 647-653.e1-653.3.
- Kaya A et al. Characteristics and prognosis of allergic proctocolitis in infants. J Pediatr Gastroenterol Nutr 2015 ; 61 : 69-73.
- Kaya A et al. Food protein-induced enterocolitis syndrome in two exclusively breastfed infants. Pediatr Allergy Immunol 2016 ; 27 : 749-50.
- Kilshaw PJ, Cant AJ. The passage of maternal dietary proteins into human breast milk. Int Arch Allergy Appl Immunol 1984 ; 75 : 8-15.
- Krejci-Manwaring J et al. Stealth monitoring of adherence to topical medication : adherence is very poor in children with atopic dermatitis. J Am Acad Dermatol 2007 ; 56 : 211-6.
- Lake AM. Dietary protein enterocolitis. Curr Allergy Rep 2001 ; 1 : 76-9.
- Lake AM. Food-induced eosinophilic proctocolitis. J Pediatr Gastroenterol Nutr 2000 ; 30 : S58-60.
- Lifschitz CH et al. Anaphylactic shock due to cow’s milk protein hypersensitivity in a breastfed infant. J Pediatr Gastroenterol Nutr 1988 ; 7 : 141-4.
- Loening-Baucke V. Prevalence, symptoms and outcome of constipation in infants and toddlers. J Pediatr 2005 ; 146 : 359-63.
- Lucassen PL et al. Effectiveness of treatments for infantile colic : systematic review. BMJ 1998 ; 316 : 1563-9.
- Martin-Munoz MF et al. Food allergy in breastfeeding babies : hidden allergens in human milk. Eur Ann Allergy Clin Immunol 2016 ; 48 : 123-8.
- Mehta H et al. Growth comparison in children with and without food allergies in 2 different demographic populations. J Pediatr 2014 ; 165 : 842-8.
- Metcalfe JR et al. Effects of maternal dietary egg intake during early lactation on human milk ovalbumin concentration : a randomized controlled trial. Clin Exp Allergy 2016 ; 46 : 1605-13.
- Meyer R et al. International survey on growth indices and impacting factors in children with food allergies. J Hum Nutr Diet 2019 ; 32 : 175-84.
- Meyer R et al. Malnutrition in children with food allergies in the UK. J Hum Nutr Diet 2014 ; 27 : 227-35.
- Miceli Sopo S et al. Chronic food protein-induced enterocolitis syndrome caused by cow’s milk proteins passed through breast milk. Int Arch Allergy Immunol 2014 ; 164 : 207-9.
- Michelet M et al. Food protein-induced enterocolitis syndrome – a review of the literature with focus on clinical management. J Asthma Allergy 2017 ; 10 : 197-207.
- Monti G et al. Anaphylaxis due to fish hypersensitivity in an exclusively breastfed infant. Acta Paediatr 2006 ; 95 : 1514-5.
- Monti G et al. Food protein-induced enterocolitis syndrome by cow’s milk proteins passed through breast milk. J Allergy Clin Immunol 2011 ; 127 : 679-80.
- Muller M et al. The utility of guaiac stool testing in the detection of gastrointestinal complications in infants with critical congenital heart disease. Cardiol Young 2019 ; 29 : 655-9.
- Nielsen RG et alSevere gastro-esophageal reflux disease and cow milk hypersensitivity in infants and children : disease association and evaluation of a new challenge procedure. J Pediatr Gastroenterol Nutr 2004 ; 39 : 383-91.
- Nowak-Wegrzyn A et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome : executive summary – Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol 2017 ; 139 : 1111-1126.e4.
- Nowak-Wegrzyn A et al. Non-IgE-mediated gastrointestinal food allergy. J Allergy Clin Immunol 2015 ; 135 : 1114-24.
- Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome and allergic proctocolitis. Allergy Asthma Proc 2015 ; 36 : 172-84.
- Odze RD et al. Allergic colitis in infants. J Pediatr 1995 ; 126 : 163-70.
- Ohsaki A et al. Maternal IgG immune complexes induce food allergen-specific tolerance in offspring. J Exp Med 2018 ; 215 : 91-113.
- Palmer DJ et al. Effect of cooked and raw egg consumption on ovalbumin content of human milk : a randomized, double-blind, cross-over trial. Clin Exp Allergy 2005 ; 35 : 173-8.
- Rance F. Food allergy in children suffering from atopic eczema. Pediatr Allergy Immunol 2008 ; 19 : 279-84.
- Robbins KA et al. Growth and nutrition in children with food allergy requiring amino acid-based nutritional formulas. J Allergy Clin Immunol 2014 ; 134 : 1463-1466.e5.
- Roduit C et al. Development of atopic dermatitis according to age of onset and association with early-life exposures. J Allergy Clin Immunol 2012 ; 130 : 130-136.e5.
- Roepke JL, Kirksey A. Vitamin B6 nutriture during pregnancy and lactation, I : vitamin B6 intake, levels of the vitamin in biological fl uids, and condition of the infant at birth. Am J Clin Nutr 1979 ; 32 : 2249-56.
- Sampson HA. The evaluation and management of food allergy in atopic dermatitis. Clin Dermatol 2003 ; 21 : 183-92.
- Schneider L et al. Atopic dermatitis : a practice parameter update 2012. J Allergy Clin Immunol 2013 ; 131 : 295-299.e1-299.e27.
- Schocker F et al. Detection of the peanut allergens Ara h 2 and Ara h 6 in human breast milk : development of 2 sensitive and specific sandwich ELISA assays. Int Arch Allergy Immunol 2017 ; 174 : 17-25.
- Schocker F et al. Individual sensitization pattern recognition to cow’s milk and human milk differs for various clinical manifestations of milk allergy. Nutrients 2019 ; 11 : E1331.
- Schocker F et al. Persistent cow’s milk anaphylaxis from early childhood monitored by IgE and BAT to cow’s and human milk under therapy. Pediatr Allergy Immunol 2018 ; 29 : 210-4.
- Schocker F et al. Prospective investigation on the transfer of Ara h 2, the most potent peanut allergen, in human breast milk. Pediatr Allergy Immunol 2016 ; 27 : 348-55.
- Schulmeister U et al. Sensitization to human milk. Clin Exp Allergy 2008 ; 38 : 60-8.
- Sicherer SH et al. Clinical features of food protein-induced enterocolitis syndrome. J Pediatr 1998 ; 133 : 214-9.
- Sicherer SH. Clinical aspects of gastrointestinal food allergy in childhood. Pediatrics 2003 ; 111 : 1609-16.
- Sidbury R et al. Guidelines of care for the management of atopic dermatitis : section 4, prevention of disease flares and use of adjunctive therapies and approaches. J Am Acad Dermatol 2014 ; 71 : 1218-33.
- Sorva R et al. Beta-lactoglobulin secretion in human milk varies widely after cow’s milk ingestion in mothers of infants with cow’s milk allergy. J Allergy Clin Immunol 1994 ; 93 : 787-92.
- Spergel JM et al. 14 years of eosinophilic esophagitis : clinical features and prognosis. J Pediatr Gastroenterol Nutr 2009 ; 48 : 30-6.
- Staiano A et al. Differentiation of cows’ milk intolerance and gastro-oesophageal reflux. Arch Dis Child 1995 ; 73 : 439-42.
- Sullivan PB. Cows ’ milk induced intestinal bleeding in infancy. Arch Dis Child 1993 ; 68 : 240-5.
- Tan J et al. Food protein-induced enterocolitis syndrome in an exclusively breastfed infant — an uncommon entity. J Allergy Clin Immunol 2012 ; 129 : 873.
- Thompson MM, Hanifin JM. Effective therapy of childhood atopic dermatitis allays food allergy concerns. J Am Acad Dermatol 2005 ; 53 : S214-9.
- Uenishi T et al. Aggravation of atopic dermatitis in breastfed infants by tree nut-related foods and fermented foods in breast milk. J Dermatol 2011 ; 38 : 140-5.
- Vadas P et al. Detection of peanut allergens in breast milk of lactating women. JAMA 2001 ; 285 : 1746-8.
- Vandenplas Y et al. Practical algorithms for managing common gastrointestinal symptoms in infants. Nutrition 2013 ; 29 : 184-94.
- Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema : ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet 1998 ; 351 : 1225-32.
- Xanthakos SA et al. Prevalence and outcome of allergic colitis in healthy infants with rectal bleeding : a prospective cohort study. J Pediatr Gastroenterol Nutr 2005 ; 41 : 16-22.
- Zielinska MA et al. Carotenoid content in breastmilk in the 3rd and 6th month of lactation and its associations with maternal dietary intake and anthropometric characteristics. Nutrients 2019 ; 11 : E193.







Pour poser une question, n'utilisez pas l'espace "Commentaires" ci-dessous, envoyez un mail à la boîte contact. Merci