Publié dans le n° 192 des Dossiers de l'allaitement, mars 2023.
D'après : Supporting lactation in otolaryngology patients through medication optimization, radiology considerations, and more : a literature review. Elder E et al. JAMA Otolaryngol Head Neck Surg 2022 ; 148(10) : 973-80.
De nombreuses mères n’allaitent pas aussi longtemps que prévu au départ. Une des causes de sevrage précoce est la prise maternelle d’un traitement médicamenteux (Odom). De nombreuses études ont constaté que les médecins avaient des connaissances médiocres sur l’allaitement, incluant la prescription de médicaments chez la mère allaitante (Amir ; Freed ; Pound). Bien souvent, ils recommandent la suspension ou l’arrêt de l’allaitement s’ils prescrivent certains examens ou un traitement. Les pathologies oto-rhino-laryngologiques (ORL) sont relativement fréquentes, y compris chez les mères allaitantes, et elles pourront néces-siter un traitement médical ou chirurgical. Afin de permettre aux mères de ne pas suspendre ou arrêter l’allaitement alors que ce n’est pas nécessaire, les médecins et chirurgiens ORL ont besoin d’avoir des connaissances sur la gestion des problèmes ORL pendant l’allaitement. Cet article fait le point sur le sujet.
Considérations générales
De nombreux facteurs déterminent le niveau d’excrétion lactée d’un médicament, incluant la posologie, le taux plasmatique maternel, le poids moléculaire du produit actif, sa liposolubilité, son degré de liaison aux protéines plasmatiques, son ionisation, ainsi que certaines caractéristiques métaboliques individuelles (McCarter-Spaulding). La majorité des médicaments passent dans le lait par diffusion passive jusqu’à obtention d’un équilibre entre le taux plasmatique et le taux lacté, le rapport entre ces deux taux étant déterminé par les caractéristiques de ces deux milieux. Par exemple, un produit hautement liposoluble se concentrera dans le lait, dont le taux de lipides est beaucoup plus élevé que celui du plasma. Si les petites molécules passent facilement dans le lait, ce n’est pas le cas des produits de haut poids moléculaire (héparines par exemple). Le lait est habituellement plus acide que le plasma, ce qui favorise l’excrétion lactée des molécules basiques. Enfin, le risque potentiel pour l’enfant allaité dépendra de l’âge de l’enfant, de la toxicité intrinsèque du produit, de sa biodisponibilité orale, du pourcentage de lait maternel dans l’alimentation de l’enfant et du taux lacté du produit actif. À partir de divers paramètres, on calcule la dose relative à laquelle l’enfant est exposé, à savoir le pourcentage de la dose maternelle ajustée pour le poids qu’il reçoit via le lait maternel (Smathers). Si ce pourcentage est inférieur à 10 % de la dose maternelle (ou de la dose pédiatrique), on estime qu’un effet secondaire chez l’enfant est très improbable (sauf toxicité importante du produit).
Planification autour d’une intervention chirurgicale
La nécessité de subir une chirurgie est habituellement un stress important pour une mère allaitante qui, outre ses problèmes de santé, devra être séparée de son bébé et gérer sa lactation. L’ocytocine sécrétée pendant les tétées a un impact calmant, et les tétées peuvent donc aider la mère avant l’intervention, mais également après celle-ci. Lorsqu’un chirurgien doit opérer une femme allaitante, il doit s’enquérir de ses souhaits par rapport à son allaitement. Chaque fois que possible, la chirurgie sera effectuée en ambulatoire, ou avec une hospitalisation pour la journée. On peut également discuter de la possibilité de lui amener son bébé avant l’intervention, puis après celle-ci en salle de réveil. Si les médicaments administrés imposent une suspension de l’allaitement, on mettra en place avec la mère des mesures préservant l’allaitement : préparation d’un stock de lait avant l’intervention, que le bébé pourra recevoir pendant la période de suspension de l’allaitement, utilisation d’un tire-lait pendant toute la période de suspension de l’allaitement pour maintenir la production lactée.
L’anesthésiste doit tenir compte de l’allaitement et adapter en conséquence le protocole d’anesthésie (Lobkova ; Mitchell). Il administrera les doses efficaces les plus faibles possible et privilégiera les produits à courte demi-vie. On encouragera la mère à tirer son lait juste avant l’anesthésie. Si l’intervention dure plus de 4 heures, une personne présente en salle d’opération sera chargée d’exprimer le lait en utilisant un tire-lait stérilisé. On a constaté que l’utilisation de povidone iodée (Bétadine®) pour la désinfection de la zone opératoire pouvait augmenter le taux lacté d’iode et induire une hypothyroïdie chez le bébé allaité, mais ce produit est très faiblement absorbé au niveau de la peau saine, ce qui limitera le passage lacté de l’iode (Koga). On pourra veiller à limiter la surface badigeonnée et ne pas répéter les applications. Il est également possible d’utiliser un autre produit, comme la chlorhexidine.
Après l’intervention, 500 à 1 000 ml supplémentaires de fluides intraveineux devraient être administrés pour maintenir la production lactée, sauf si l’allaitement est contre-indiqué (Lobkova). Les seins de la mère devraient être régulièrement surveillés afin de détecter la survenue d’un engorgement (Simon). Le risque de mastite est particulièrement élevé si la chirurgie est effectuée pendant les 6 premières semaines post-partum (Amir), et si l’état de la mère nécessite une hospitalisation en soins intensifs. Si nécessaire, on aidera la mère à tirer son lait si elle n’est pas capable de le faire elle-même. Chaque fois que possible, la mère sera hospitalisée avec son bébé afin de pouvoir recommencer à l’allaiter aussi rapidement qu’elle en sera capable.
Analgésiques
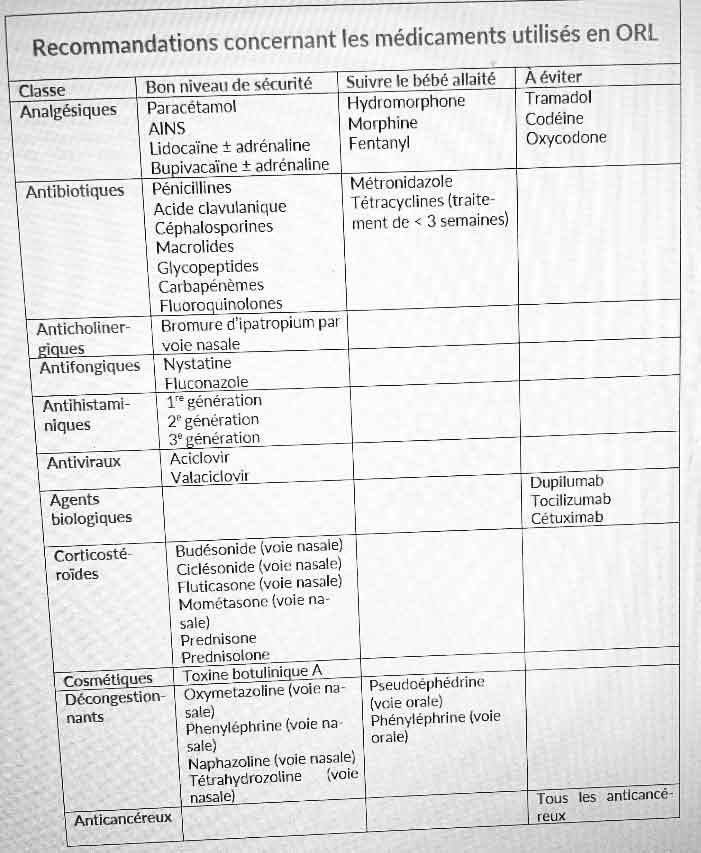
La plupart des analgésiques peuvent être administrés pendant l’allaitement, et une mère ne devrait pas avoir à choisir entre ne pas souffrir et allaiter. Le paracétamol est un bon choix, l’enfant allaité étant exposé en moyenne à 1,1 % de la dose maternelle ajustée pour le poids (Notarianni). Peu d’effets secondaires ont été rapportés chez les bébés allaités. Les anti-inflammatoires non stéroïdiens tels que l’ibuprofène, le diclofénac, le naproxène, l’indométacine ou le kétorolac sont faiblement excrétés dans le lait humain et sont compatibles avec l’allaitement. L’ibuprofène est le premier choix en raison de son excrétion lactée infime, de sa courte demi-vie et de son utilisation en pédiatrie (Bar-Oz). Si l’aspirine peut être utilisée comme antiplaquettaire pendant l’allaitement en raison des faibles doses administrées, son utilisation aux doses analgésiques pendant plusieurs jours sera prudente en raison de son excrétion lactée significative, susceptible d’induire des saignements chez le bébé allaité, voire une acidose (Clark ; Datta). Le bébé allaité devrait être surveillé.
La plupart des opiacés sont utilisables ponctuellement pendant l’allaitement, même si les données concernant leur utilisation pendant l’allaitement sont succinctes (Spigset). Dans des conditions normales d’utilisation, il existe peu de rapports de cas de toxicité et a priori un seul cas de décès d’un petit nourrisson allaité par une mère sous opiacés, la responsabilité de cet opiacé étant contestée (Zipurski). Leur utilisation pour un traitement court ne devrait pas être déconseillée aux mères. À noter que si la mère supporte mal les opiacés, il sera nécessaire de surveiller l’enfant de plus près (Mitchell). En cas de traitement au long cours, les parents doivent être avertis de l’importance d’une surveillance de leur bébé à la recherche d’une sédation, d’une prise de poids insuffisante ou d’un retard du développement. Les mères allaitantes prenant de la méthadone ou de la buprénorphine pour le traitement d’une addiction aux opiacés devraient être encouragées à allaiter à partir du moment où elles sont correctement suivies dans le cadre de leur programme d’abstinence.
L’hydromorphone et la morphine sont faiblement excrétées dans le lait. Après administration intranasale, l’enfant allaité est exposé à environ 0,67 % de la dose maternelle ajustée pour le poids (Edwards). Le tramadol n’est pas le meilleur choix pendant l’allaitement. Un cas de décès d’un bébé de 8 mois allaité par une mère sous tramadol a été rapporté, mais il est peu probable que le tramadol excrété dans le lait soit en cause étant donné les caractéristiques de ce cas (Hussien). D’autres études n’ont pas rapporté d’effets secondaires attribuables au tramadol (Ilet ; Nagae ; Palmer). De même, la codéine et l’oxycodone ne sont pas recommandées pendant l’allaitement et d’autres produits sont préférables (Lazaryan ; Sachs). Ils ont des métabolites actifs et la rapidité de leur métabolisation dépend de facteurs génétiques. Or, il est impossible de savoir si une personne les métabolisera lentement ou très rapidement. Les mères allaitantes qui sont métaboliseurs ultrarapides auront un taux lacté significativement plus élevé de morphine, ce qui peut avoir un impact négatif sur le bébé allaité.
Concernant les anesthésiques locaux injectables tels que la lidocaïne ou la bupivacaïne, de nombreuses études ont évalué leur excrétion lactée et aucune précaution particulière n’est nécessaire concernant l’allaitement. Ils sont faiblement excrétés dans le lait et leur biodisponibilité orale est basse (Anderson). La combinaison lidocaïne/adrénaline est également compatible avec l’allaitement : la vasoconstriction induite par l’adrénaline abaisse encore le passage de la lidocaïne dans la circulation générale, et l’adrénaline a une courte demi-vie (Giuliani).
Antibiotiques
La plupart des antibiotiques sont utilisables pendant l’allaitement. Les pénicillines sont faiblement excrétées dans le lait, et un impact chez le bébé allaité est hautement improbable. L’association amoxicilline/acide clavulanique est couramment utilisée dans le traitement des infections à germes possédant une bêta-lactamase, et elle est compatible avec l’allaitement (Benyamini). Les céphalosporines de 1re, 2e et 3e générations sont compatibles avec l’allaitement et sont indétectables dans le sérum des bébés allaités.
On se pose des questions concernant la sécurité du métronidazole (Birodogyl®, Flagyl®…) pendant l’allaitement en raison de son impact carcinogène chez les animaux et de son possible impact mutagène chez les humains (Dobiás). Il est utilisé en pédiatrie pour le traitement d’infections à germes anaérobies à des doses bien plus élevées que celles auxquelles le bébé est exposé en cas de traitement maternel (0,9 % de la dose maternelle ajustée pour le poids). Toutefois, lorsque d’autres produits sont disponibles, on préférera leur utilisation à celle du métronidazole chez une mère allaitante.
Les macrolides passent faiblement dans le lait humain et ils sont utilisés en pédiatrie. Ils sont utilisables pendant l’allaitement. Les glycopeptides tels que la vancomycine ont une faible biodisponibilité orale, et un effet négatif chez le bébé exposé via le lait maternel est improbable (Reyes). Les carbapénèmes (ertapénem – Invanz®, imipénem – Recarbrio®, Tienam®, doripénem – Doribax®, tébipénem et méropénem – Meronem®, Veronem®) sont des antibiotiques à large spectre administrés par voie parentérale. Ils sont faiblement excrétés dans le lait humain et leur biodisponibilité orale est basse, mais ils peuvent induire des troubles gastro-intestinaux chez le bébé allaité. Les fluoroquinolones ont longtemps été contre-indiquées en raison de la crainte d’un impact articulaire négatif, mais des études ont constaté que ce risque était faible (Kaguelidou). Leur utilisation est compatible avec l’allaitement, le bébé étant régulièrement suivi. L’administration locale (gouttes auriculaires) présente un risque négligeable pour le bébé allaité. Les tétracyclines ont longtemps été contre-indiquées pendant l’allaitement en raison de leur impact sur la dentition et les os du bébé. Toutefois, les données existantes montrent qu’un traitement courant (jusqu’à 3 semaines de traitement) est peu susceptible d’induire un quelconque problème chez le bébé allaité, et les tétracyclines sont donc utilisables dans ce cadre chez la mère allaitante (Matsuda).
L’aciclovir (Zovirax®) et le valaciclovir (Zélitrex®) sont des antiviraux. Ils passent très faiblement dans le lait maternel même en cas de doses massives administrées à la mère. Aucun impact négatif n’a jamais été rapporté suite à leur utilisation chez une mère allaitante (Drake ; Sheffield ; Taddio).
Concernant les antifongiques, il n’existe aucune donnée concernant l’excrétion lactée de la nystatine (Auricularum®, Nystatine®). Toutefois, sa biodisponibilité orale est quasi nulle et elle est utilisée en pédiatrie. Elle est compatible avec l’allaitement. Le fluconazole (Beagyne®, Triflucan®) est excrété dans le lait maternel à un taux nettement plus bas que la posologie utilisée chez les nourrissons, ce taux lacté étant trop bas pour traiter une candidose orale chez un nourrisson lorsqu’une mère en prend pour le traitement d’une candidose des mamelons (Kaplan).
Corticostéroïdes
Administrés par voie nasale, les corticostéroïdes tels que le budésonide, le ciclénoside (Alvesco®), la fluticasone (Flixotide®) et le mométazone (Nasonex®) sont compatibles avec l’allaitement. C’est également le cas des corticoïdes administrés par voie générale. Leur demi-vie est courte, ils passent peu dans le lait et en sont rapidement éliminés. Aucun effet secondaire n’a été rapporté suite à leur utilisation par une mère allaitante. Toutefois, en cas de traitement maternel au long cours avec une posologie élevée, on pourra suggérer à la mère de suspendre l’allaitement pendant 3 à 4 heures après la prise, ce qui limitera l’exposition du bébé allaité (Middleton). La prednisone et la prednisolone sont à privilégier en raison de leur excrétion lactée particulièrement basse. Une étude a constaté que des doses quotidiennes de 80 mg/jour de prednisolone exposaient le bébé allaité à < 0,1 % de la dose maternelle ajustée pour le poids (Ost).
Il n’existe aucune donnée sur l’excrétion lactée de l’ipratropium (Atrovent®), administré par voie nasale. Toutefois, il passe très peu dans le sang maternel et une excrétion lactée mesurable est donc très improbable. De plus, sa biodisponibilité orale est nulle. Les décongestionnants systémiques devraient être utilisés avec précaution en raison de leur impact négatif sur la production lactée. Une dose unique de pseudoéphédrine abaisse la production lactée et une utilisation répétée interfèrera avec l’allaitement (Aljazaf). Des cas d’irritabilité ont été rapportés chez 20 % des nourrissons exposés à la pseudoéphédrine (Ito). La phényléphrine peut également abaisser la production lactée. Il est préférable d’utiliser d’autres produits. Les décongestionnants administrés par voie nasale sont compatibles avec l’allaitement dans la mesure où ils passent peu dans le sang maternel et que le bébé y sera donc très peu exposé (Anderson).
Antihistaminiques
Les antihistaminiques de première génération tels que le diménhydrinate (Mercalm®, Nausi-calm®), pris à haute dose ou au long cours, peuvent abaisser la production lactée et induire une irritabilité chez le bébé allaité (Ito).
L’utilisation ponctuelle à doses plus faibles est peu susceptible de poser un problème chez le bébé. Prendre le produit le soir au coucher après la dernière tétée limitera la possibilité d’un impact. Les antihistaminiques de seconde génération sont de meilleurs choix pendant l’allaitement. Une prise au long cours et des doses élevées peuvent induire une sédation chez le bébé allaité (Ito). Les antihistaminiques de troisième génération tels que la loratadine (Aérius®), la féxofénadine (Telfast®) ou la cérérizine (Virlix®, Zyrtec®) sont peu susceptibles d’induire un quelconque impact chez le bébé allaité (Hilbert ; Wilkerson). Ils n’ont pas l’impact sédatif des antihistaminiques des générations précédentes et ils passent peu dans le lait. Ils pourraient avoir un impact négatif sur la production lactée, en particulier en combinaison avec un sympathomimétique.
Agents biologiques
Il existe très peu de données sur l’excrétion lactée de ces produits, qui devraient donc être utilisés avec prudence chez la mère allaitante. Ces produits ont cependant un poids moléculaire élevé et ils doivent être administrés par voie parentérale. L’impact éventuel du dupilumab (Dupixent®) chez le bébé allaité par une mère traitée par ce produit n’a pas été évalué. Le tocilizunab (Roactemra®) n’a pas été retrouvé dans le sérum des bébés allaités et aucun impact n’a été rapporté suite à son utilisation chez une mère allaitante (Salonga).
Agents oncologiques
Les produits utilisés pour les chimiothérapies contre-indiquent généralement l’allaitement en raison de leur toxicité, mais il existe en fait très peu de données sur leur excrétion lactée et leur éventuel impact chez le bébé allaité (Pistilli). On a constaté que le fluorouracile (Elvorine®) et l’étoposide (Etopophos) sont le plus souvent indétectables dans le lait maternel 12 heures après leur administration (Stopenski). La doxorubicine (Adriblastine®), le cisplatine, la mitoxantrone (Novantrone®) et le méthotrexate (Imeth®) ne doivent pas être utilisés pendant l’allaitement en raison de leur rapport lait/plasma élevé. Les chimiothérapies ont également un impact négatif sur le microbiote lacté et la composition du lait maternel. Les mères allaitantes qui doivent suivre une chimiothérapie anticancéreuse doivent être informées sur ces produits et sur le fait que l’allaitement est habituellement contre-indiqué. Le cétuximab (Erbitux®) est un anticorps monoclonal. Son poids moléculaire est élevé et il doit être administré par voie parentérale, mais il n’existe aucune donnée sur son excrétion lactée ou son impact éventuel sur le nourrisson. Le fabricant recommande de suspendre l’allaitement pendant les 60 jours suivant son utilisation. Cela n’est pas forcément nécessaire, mais ce produit sera utilisé avec précaution, en particulier si la mère allaite un nouveau-né ou un prématuré.
Produits cosmétiques
La toxine botulinique (Botox®) ne passe pas dans le sang à un taux mesurable après administration intramusculaire, et elle ne devrait donc pas être retrouvée dans le lait (Nigam). Une mère allaitant un bébé de 8 mois a présenté un botulisme pour lequel elle a été hospitalisée, et elle a poursuivi l’allaitement sans que son bébé présente le moindre problème (Middaugh). Ni la toxine ni le Clostridium botulinum n’ont jamais été retrouvés dans du lait humain. Aucune étude sur la sécurité de l’utilisation de l’acide hyaluronique pendant la grossesse et la lactation n’a été publiée et aucune recommandation ferme ne peut être donnée à son sujet.
Imagerie médicale
Les mères allaitantes pourront avoir besoin de faire des examens d’imagerie médicale dans le cadre de la gestion d’une pathologie ORL, et ces examens sont le plus souvent compatibles avec l’allaitement (Tremblay). Les radiographies avec ou sans produit de contraste iodé sont compatibles avec l’allaitement, ainsi que les IRM avec produit à base de gadolinium. L’excrétion lactée de ces produits est négligeable. Pour les examens nécessitant l’administration d’un radioisotope, la conduite à tenir est fonction du produit et de la dose administrée. On peut consulter des documents sur le sujet (Administration of radioactive substances advisory committee, pages 61-66 pour l’utilisation pendant la lactation).
En conclusion
La préservation de l’allaitement chez les mères qui le souhaitent devrait être une priorité pour les médecins et chirurgiens spécialisés en ORL. La majorité des médicaments prescrits en ORL sont utilisables chez ces mères. En cas d’hospitalisation, la mère devrait être admise avec son bébé allaité chaque fois que possible, et on devrait l’aider à tirer son lait si ce n’est pas le cas ou si elle est trop malade pour le faire seule. Les examens, traitements et interventions seront discutés avec les parents sur le plan de leurs risques éventuels pour le bébé allaité. Les professionnels de santé qui ne sont pas sûrs de la compatibilité d’un traitement avec l’allaitement peuvent consulter diverses sources d’information sur le sujet (le CRAT en France, http://lecrat.fr/ ; en anglais, LactMed, https://www.ncbi.nlm.nih.gov/books/NBK501922/ ; Lactancia en anglais/espagnol : https://e-lactancia.org/).
Références
• Administration of Radioactive Substances Advisory Committee. Notes for guidance on the clinical admin-istration of radiopharmaceuticals and use of sealed radioactive sources. 2022. assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1049915/Notes_for_guidance_on_the_clinical_administration_of_radiopharmaceuticals_and_use_of_sealed_radioactive_sources.pdf
• Aljazaf K et al. Pseudoephedrine : effects on milk production in women and estimation of infant exposure via breastmilk. Br J Clin Pharmacol 2003 ; 56 : 18-24.
• Amir LH, Pirotta MV. Medicines for breastfeeding women : a postal survey of general practitioners in Victo-ria. Med J Aust 2009 ; 191 : 126.
• Anderson PO. Decongestants and milk production. J Hum Lact 2000 ; 16 : 294.
• Anderson PO. Local anesthesia and breastfeeding. Breastfeed Med 2021 ; 16 : 173-4.
• Bar-Oz B et al. Use of antibiotic and analgesic drugs during lactation. Drug Saf 2003 ; 26 : 925-35.
• Benyamini L et al. The safety of amoxicillin/clavulanic acid and cefuroxime during lactation. Ther Drug Monit 2005 ; 27 : 499-502.
• Clark JH, Wilson WGA. A 16-day-old breast-fed infant with metabolic acidosis caused by salicylate. Clin Pediatr 1981 ; 20 : 53-4.
• Datta P et al. Transfer of low dose aspirin into human milk. J Hum Lact. 2017 ; 33 : 296-9.
• Dobiás L et al. Genotoxicity and carcinogenicity of metronidazole. Mutat Res 1994 ; 317 : 177-94.
• Edwards JE et al. Hydromorphone transfer into breast milk after intranasal administration. Pharmacothera-py. 2003 ; 23(2) : 153-158.
• Freed GL et al. National assessment of physicians’ breast-feeding knowledge, attitudes, training, and expe-rience. JAMA 1995 ; 273 : 472-6.
• Giuliani M et al. Could local anesthesia while breast-feeding be harmful to infants ? J Pediatr Gastroenterol Nutr 2001 ; 32 : 142-4.
• Hilbert J et al. Excretion of loratadine in human breast milk. J Clin Pharmacol 1988 ; 28 : 234-9.
• Hussien R. Tramadol intoxication in an 8-months-old infant through breastfeeding : a case report. J Clin Toxicol 2017 ; 7 : 335.
• Ilett KF et al. Use of a sparse sampling study design to assess transfer of tramadol and its O-desmethyl metabolite into transitional breast milk. Br J Clin Pharmacol 2008 ; 65 : 661-6.
• Ito S et al. Prospective follow-up of adverse reactions in breast-fed infants exposed to maternal medication. Am J Obstet Gynecol 1993 ; 168 : 1393-9.
• Kaguelidou F et al. Ciprofloxacin use in neonates : a systematic review of the literature. Pediatr Infect Dis J 2011 ; 30 : e29-37.
• Kaplan YC et al. Fluconazole use during breastfeeding. Can Fam Physician 2015 ; 61 : 875-6.
• Katrina B et al. Academy of Breastfeeding Medicine Clinical Protocol #36 : The Mastitis Spectrum, Revised 2022. Breastfeed Med 2022 ; 17(5) : 360-76. //www.lllfrance.org/vous-informer/fonds-documentaire/textes-de-l-academy-of-breastfeeding-medicine/2248-le-spectre-des-mastites
• Koga Y et al. Effect on neonatal thyroid function of povidone-iodine used on mothers during perinatal peri-od. J Obstet Gynaecol 1995 ; 21 : 581-5.
• Lobkova N, Wolf EW. Performing elective surgery on the breastfeeding patient : a review of the literature. Foot Ankle Spec 2014 ; 7 : 226-31.
• Matsuda S. Transfer of antibiotics into maternal milk. Biol Res Pregnancy Perinatol 1984 ; 5 : 57-60.
• McCarter-Spaulding DE. Medications in pregnancy and lactation. MCN Am J Matern Child Nurs 2005 ; 30 : 10-7.
• Middaugh J. Botulism and breast milk. N Engl J Med 1978 ; 298 : 343.
• Middleton PG et al. ERS/TSANZ Task Force Statement on the management of reproduction and pregnancy in women with airways diseases. Eur Respir J 2020 ; 55 : 1901208.
• Mitchell J et al. Guideline on anaesthesia and sedation in breastfeeding women 2020 : guideline from the Association of Anaesthetists. Anaesthesia 2020 ; 75 : 1482-93.
• Nagae Seika P et al. Safety of tramadol hydrochloride/acetaminophen combination tablet use for postpar-tum pain. J Obstet Gynaecol Res. 2021 ; 47 : 2919.
• Nigam PK, Nigam A. Botulinum toxin. Indian J Dermatol 2010 ; 55 : 8-14.
• Notarianni LJ et al. Passage of paracetamol into breast milk and its subsequent metabolism by the neonate. Br J Clin Pharmacol 1987 ; 24 : 63-7.
• Odom EC et al. Reasons for earlier than desired cessation of breastfeeding. Pediatrics 2013 ; 131(3) : e726-32.
• Ost L et al. Prednisolone excretion in human milk. J Pediatr 1985 ; 106 : 1008-11.
• Palmer GM et al. Tramadol, breast feeding and safety in the newborn. Arch Dis Child. 2018 ; 103 : 1110-3.
• Pistilli B et al. Chemotherapy, targeted agents, antiemetics and growth-factors in human milk : how should we counsel cancer patients about breastfeeding ? Cancer Treat Rev 2013 ; 39 : 207-11.
• Pound CM et al. Breastfeeding knowledge, confidence, beliefs, and attitudes of Canadian physicians. J Hum Lact 2014 ; 30 : 298-309.
• Reyes MP, Ostrea EM Jr, Cabinian AE, et al. Vancomycin during pregnancy : Does it cause hearing loss or nephrotoxicity in the infant ? Am J Obstet Gynecol 1989 ; 161 : 977-81.
• Salonga A et al. A case series of patients with rheumatoid arthritis exposed to tocilizumab during pregnan-cy. Intern Med J 2018 ; 48 : 26-27.
• Sheffield JS et al. Acyclovir concentrations in human breast milk after valaciclovir administration. Am J Obstet Gynecol 2002 ; 186 : 100-2.
• Simon JA et al. Perioperative care of the breastfeeding patient. AORN J 2018 ; 107 : 465-74.
• Smathers AB et al. Perianesthetic considerations for the breastfeeding mother. J Perianesth Nurs 2016 ; 31 : 317-29.
• Spigset O, Hägg S. Analgesics and breast-feeding : safety considerations. Paediatr Drugs 2000 ; 2 : 223-38.
• Stopenski S et al. After chemotherapy treatment for maternal cancer during pregnancy, is breastfeeding possible ? Breastfeed Med 2017 ; 12 : 91-7.
• Taddio A et al. Acyclovir excretion in human breast milk. Ann Pharmacother 1994 ; 28 : 585-7.
• Tremblay E et al. Quality initiatives : guidelines for use of medical imaging during pregnancy and lactation. Radiographics 2012 ; 32 : 897-911.
• Wilkerson H et al. Maternal transfer of cetirizine into human milk. J Hum Lact 2021 ; 37 : 135-8.
• Yonke N et al. Breastfeeding motivators and barriers in women receiving medications for opioid use disorder. Breastfeed Med 2020 ; 15 : 17-23.
• Zipursky J, Juurlink DN. The implausibility of neonatal opioid toxicity from breastfeeding. Clin Pharmacol Ther 2020 ; 108 : 964-70.







Pour poser une question, n'utilisez pas l'espace "Commentaires" ci-dessous, envoyez un mail à la boîte contact. Merci